Introduction
De nombreuses études ont prouvé depuis 15 ans que la stimulation du noyau sous-thalamique (STN) ou du globus pallidus interne (Gpi) au moyen d’électrodes intracérébrales peut fortement réduire, voire supprimer totalement les fluctuations motrices (akinésie de fin de dose, effets “on-off”, dyskinésies) chez des patients parkinsoniens soigneusement sélectionnés (Limousin et al. 1998, Deuschl et al. 2006). Ce traitement permet aussi d’améliorer significativement la qualité générale de vie de ces patients, tout en autorisant souvent une nette réduction des doses de médicaments administrés.
Toutefois, à côté des risques inhérents à la procédure chirurgicale (hémorragies cérébrales, infection ou défectuosités du matériel implanté, ce type d’intervention peut aussi induire des effets indésirables. Les plus fréquents: perte d’initiative et manque d’énergie, dépression parfois avec risque suicidaire, troubles de mémoire, difficultés d’élocution, prise de poids, équilibre précaire. Ces complications, même si elles ne sont pas très fréquentes, ont conduit les équipes pratiquant cette chirurgie à adopter des critères de sélection de plus en plus stricts.
Malgré ces inconvénients potentiels, plusieurs études de suivi à moyen terme ont montré que les patients implantés continuent à retirer un bénéfice substantiel de l’intervention après 5 ans, même si leurs performances motrices ne restent pas aussi bonnes qu’après un an (Krack et al. 2003). Ceci indique aussi que la stimulation cérébrale profonde ne retarde pas l’évolution naturelle de la maladie de Parkinson. Comme cette technique est relativement récente, il y a dans la littérature peu de données disponibles sur le devenir à plus long terme des patients implantés, notamment quand on les compare à ceux traités de façon traditionnelle, par médicaments uniquement. C’est le but de notre travail, en analysant non seulement les performances motrices, mais aussi la qualité globale de vie dans les deux groupes.
Entre 1997 et 2001, 25 patients atteints de maladie de Parkinson idiopathique (15 hommes et 10 femmes âgés de 51 à 74 ans avec une durée moyenne de maladie de 9.7 ans) ont été évalués comme candidats potentiels en vue d’une stimulation bilatérale du noyau sous-thalamique, sur base des critères de sélection recommandés à cette époque
Les critères d’inclusion étaient les suivants: réponse claire et durable à la L-dopa, fluctuations motrices majeures malgré un traitement fractionné, en particulier présence de périodes “off” sévères et durables, et dyskinésies invalidantes, IRM cérébrale normale, mémoire correcte pour l’âge, absence de dépression ou autres troubles psychiatriques sérieux. Tous vivaient à domicile.
Les bénéfices possibles, les risques et les contraintes de suivi médical ont été expliqués aux patients, qui ont ensuite été inclus dans deux groupes, ceux ayant choisi l’intervention chirurgicale et ceux préférant conserver uniquement un traitement médicamenteux. Tous bénéficiaient d’une prise en charge paramédicale (kinésithérapie, logopédie si nécessaire).
Ils ont été ensuite suivis de façon prospective pendant 10 ans, délai après lequel l’évaluation finale a été faite. Au moins une visite par an était requise pour rester dans l’étude.
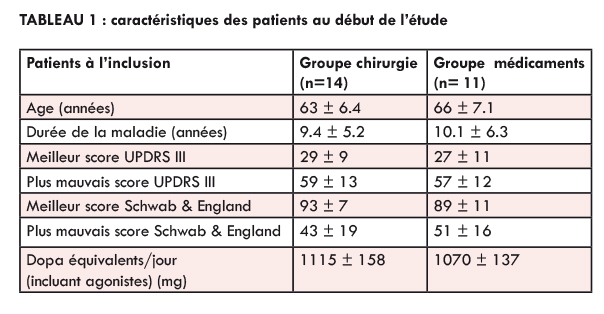
Le groupe implanté (n = 14) était un peu plus jeune (médiane 63 ans) que celui traité médicalement (n = 11, âge médian 66 ans) mais la différence n’était pas significative. Les deux groupes étaient comparables pour le reste en terme de doses de L-dopa administrée (775 vs 751 mg/jour), utilisation d’agonistes dopaminergiques (3.4 vs 3.2 mg pergolide-équivalent/jour), durée de la maladie (10.1 vs 9.4 ans), scores UPDRS et Schwab & England « off » et « on » (table 1).
La chirurgie a été effectuée dans 4 centres différents, car nous n’avons initié cette procédure à Liège qu’en 1999 (3 à Grenoble, 1 à Lille, 1 à Bruxelles and 9 à Liège). Les scores moteurs un an après l’implantation étaient similaires pour les patients implantés dans les 4 centres. Le suivi ultérieur a été effectué dans notre centre, comme celui des 11 patients traités médicalement.
Après 10 ans, les mêmes paramètres que ceux du départ ont été mesurés, plus la qualité globale de vie au moyen de l’échelle PDQ-39 scores, pas encore largement diffusée quand l’étude a été initiée. Nous avons aussi vérifié si les patients vivaient toujours à domicile ou non.
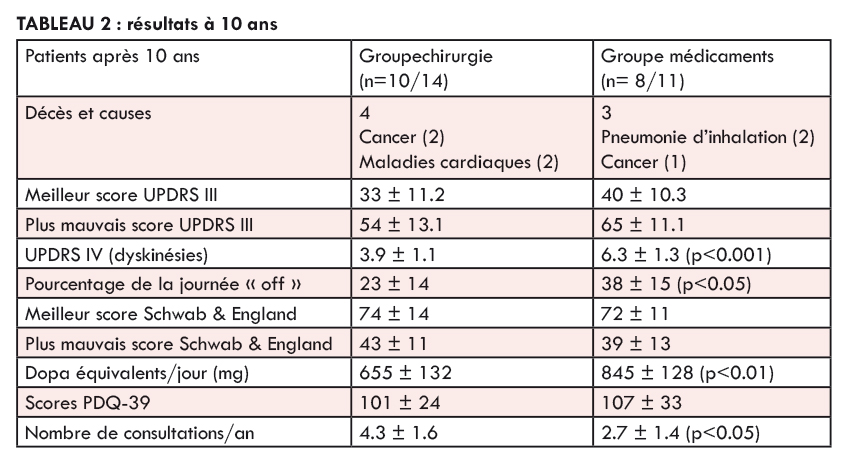
Après 10 ans, 10/14 patients étaient toujours en vie dans le groupe chirurgical contre 8/11 traités uniquement par médicaments. Aucun n’a été perdu de vue. Aucun décès n’était directement lié à la maladie de Parkinson ou à la chirurgie dans le premier groupe mais deux sont morts d’infection pulmonaire sur fausses-routes alimentaires dans le deuxième groupe ( table 2). Deux tentatives de suicide, heureusement manquées, ont été à déplorer dans le groupe chirurgical dans les trois premiers mois après l’intervention, sans récidive ultérieure.
Le nombre de patients vivant toujours à domicile après 10 ans était similaire dans les deux groupes (7/10 et 5/8). Les raisons de placement en maison de repos étaient l’apparition d’une démence ou de troubles majeurs du comportement, les chutes fréquentes, l’incontinence ou le décès du conjoint.
Bien que les patients opérés recevaient nettement moins de médicaments (table 2) les scores PDQ-39 reflétant la qualité de vie globale n’étaient pas très différents entre les deux groupes lors du suivi à 10 ans, même si les patients opérés souffraient moins de dyskinésies et de périodes “off”, gardant aussi de meilleures performances motrices globales (UPDRS III).
En interrogeant les patients, leurs familles et les soignants, il apparaît que la faible différence de qualité de vie après 10 ans entre les deux groupes était surtout liée aux complications tardives de la maladie, rebelles aux médications dopaminergiques comme à la stimulation cérébrale profonde: blocages dopa-résistants, chutes, troubles du comportement (souvent nocturnes), manque d’initiative dans le groupe chirurgical, démence et problèmes orthopédiques dans les deux groupes. Par ailleurs, les patients implantés consultaient plus souvent le neurologue que les autres, même après les périodes initiales de réglage des stimulateurs. Ces consultations supplémentaires étaient souvent motivées par la crainte de défaillance du système ou pour connaître la durée de vie résiduelle des boîtiers de stimulation ( à changer en moyenne tous les 5-6 ans).
Aussi, les doses quotidiennes de médicaments ont été réduites au fil du temps, non seulement dans le groupe traité par chirurgie, mais aussi chez les patients non implantés, avec souvent abandon des agonistes dopaminergiques. Cette réduction globale avec simplification du traitement médicamenteux a été nécessaire chez les patients ayant développé des troubles comportementaux, une démence ou une dysautonomie (chutes de tension, incontinence).
Discussion et conclusions
Que peut-on retenir de cette étude? Bien sûr, les populations étudiées sont restreintes, ce qui limite la portée statistique des mesures, mais la durée du suivi (10 ans) apporte des indications précieuses. En effet, même si diverses équipes ont bien démontré le bénéfice à court et moyen terme (5 ans) de la stimulation cérébrale profonde, il n’y a guère de données disponibles sur l’évolution ultérieure de ces patients, en particulier en ce qui concerne la qualité globale de vie.
Le présent travail, malgré ses limites, suggère que le bénéfice global de la stimulation cérébrale profonde s’atténue au fil du temps, surtout à cause de l’apparition de complications tardives de la maladie de Parkinson, résistantes aux médicaments comme à la stimulation. Il s’agit avant tout de blocages tenaces, troubles posturaux avec chutes, déclin cognitif, troubles psychiatriques et atteinte du système autonome (chutes de tension, incontinence).
Ces complications apparaissent aussi bien chez les patients traités par chirurgie que par médicaments uniquement, confirmant que la chirurgie n’a pas d’impact sur l’évolution “naturelle” de la maladie. Il faut quand même se rappeler que lors de l’évaluation finale, la durée moyenne de la maladie était de l’ordre de 20 ans dans les deux groupes.
Faut-il pour cela récuser l’utilisation de la stimulation cérébrale profonde? Sûrement pas car, si l’indication est bien posée, elle permet en quelque sorte de “revenir 5 ans en arrière” dans la plupart des cas, en diminuant nettement les fluctuations motrices et les doses de médicaments. Au contraire, ces résultats nous inciteront probablement à proposer la chirurgie plus tôt, en tout cas avant l’apparition de complications dopa-résistantes de la maladie de Parkinson. En effet, ces troubles qui ne répondent pas, même transitoirement, à la L-dopa, résistent aussi à la chirurgie.
Alain Maertens de Noordhout, Jean-Michel Remacle,
Micheline Mouchamps, Michel Gonce
Services de Neurologie et Neurochirurgie
Hôpital de la Citadelle, Liège, Belgique
al.maertens@chu.ulg.ac.be
Références
1. Maertens de Noordhout A. et al.
Functional outcome after ten years in parkinsonian patients having undergone STN DBS.
Ann Neurol. 2010 ; 68 (suppl 14): S16.
2. Limousin P. et al.
Electrical stimulation of the subthalamic nucleus in advanced Parkinson’s disease.
N Engl J Med. 1998 ; 339(16):1105-11
3. Deuschl G. et al.
A randomized trial of deep-brain stimulation for Parkinson’s disease.
N Engl J Med. 2006 Aug 31;355(9):896-908
4.. Krack P. et al.
Five-year follow-up of bilateral stimulation of the subthalamic nucleus in advanced Parkinson’s disease.
N Engl J Med. 2003 ; 349(20):1925-34