Pourquoi la maladie de Parkinson se manifeste-t-elle par des symptômes aussi différents d’un patient à l’autre ? Un consortium de chercheurs, menés par une équipe du Laboratoire CNRS d’enzymologie et biochimie structurales1 tient une piste solide. La maladie de Parkinson est causée par une protéine nommée alpha-synucléine dont les agrégats formés à l’intérieur des neurones finissent par tuer les neurones. Les chercheurs sont parvenus à caractériser et produire deux types d’agrégats d’alpha-synucléine différents entre eux. Mieux, ils ont montré que l’une de ces deux formes est beaucoup plus toxique et a une plus grande capacité à envahir les neurones. Cette découverte rend compte, à l’échelle moléculaire, de l’existence de profils d’accumulation d’alpha-synucléine différents d’un patient à l’autre. Publiés le 10 octobre dans Nature Communications, ces résultats sont une avancée notable dans la compréhension de la maladie de Parkinson. Ils permettent d’envisager de développer des thérapies adaptées pour chaque forme de cette maladie.
La maladie de Parkinson est la seconde maladie neurodégénérative la plus fréquente, après Alzheimer. Elle touche en France environ 150 000 personnes. Selon les patients, elle se manifeste par des tremblements incontrôlables (chez 60% des patients), ou par des symptômes plus diffus, comme la dépression, des troubles du comportement et différentes perturbations motrices. Ces différences dans les symptômes permettaient déjà de parler de plusieurs maladies de Parkinson.
Cette maladie, pour laquelle il n’existe pas de traitement curatif à ce jour, est causée par l’agrégation sous forme de dépôts fibrillaires d’une protéine naturellement abondante à la jonction des neurones, l’alpha-synucléine. Ces agrégats d’alpha-synucléine mal repliée se propagent d’un neurone à l’autre. Lorsqu’ils envahissent un nouveau neurone, ils sont capables de recruter l’alpha-synucléine normale pour l’ajouter au dépôt. C’est pourquoi, pour beaucoup de chercheurs, l’alpha-synucléine des agrégats doit être considérée comme une protéine infectieuse c’est-à-dire un prion. Très toxiques, les dépôts d’alpha-synucléine finissent par déclencher un processus d’apoptose, le suicide cellulaire.
Les chercheurs viennent de montrer qu’il n’existe pas qu’un seul type d’agrégat. Ils sont parvenus à produire deux types d’agrégats qui ne différent que par la façon dont s’empile la protéine. La première forme d’agrégat ressemble, à l’échelle du millionième du millimètre, à un spaghetti tandis que la deuxième est longue et aplatie, rappelant la forme d’une pâte plus large comme la linguine. Les scientifiques se sont ensuite demandé si ces différences de structure se traduisaient par des différences fonctionnelles. Pour cela, ils ont mis en contact ces deux types d’agrégat avec des cellules neuronales en culture. Résultat : la capacité de la forme « spaghetti » à se lier aux cellules et à les pénétrer était notablement supérieure à celle de la forme « linguine ». La forme « spaghetti » est aussi nettement plus toxique et tue rapidement les cellules infectées. Cette forme s’est révélée capable de résister aux mécanismes de la cellule chargés de l’éliminer, tandis que la forme « linguine » est, jusqu’à un certain degré, maîtrisée par la cellule.
Les chercheurs sont convaincus que l’existence d’au moins deux formes d’agrégats d’alpha-synucléine explique pourquoi les médecins sont confrontés à des maladies de Parkinson distinctes d’un patient à l’autre. Des travaux sur des souris sont en cours pour vérifier cette hypothèse. Par ailleurs, les scientifiques estiment que l’analyse du type d’agrégat pourrait devenir une méthode efficace de diagnostic, permettant notamment d’évaluer la virulence de la maladie pour chaque patient. Enfin, ils espèrent qu’en affinant la caractérisation de la structure des agrégats, on pourra mettre au point des stratégies thérapeutiques ciblées pour chaque variant afin de ralentir la propagation de l’alpha-synucléine anormale dans le cerveau.
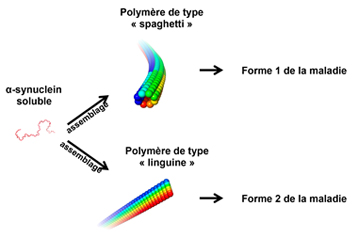
© CNRS – Luc Bousset
L’alpha-synucléine s’assemble en deux types d’agrégats. L’un ressemble, à l’échelle du millionième du millimètre, à un spaghetti. L’autre, plus aplati, rappelle la forme d’une linguine. Ces deux formes diffèrent par leurs propriétés fonctionnelles (fixation aux cellules, toxicité, persistance et propagation).
Notes :
1En collaboration notamment avec l’Institut de biologie et chimie des protéines (CNRS/Université Claude Bernard Lyon 1)
Références :
Structural and functional characterization of two alpha-synuclein strains. Luc Bousset, Laura Pieri, Gemma Ruiz-Arlandis, Julia Gath, Poul Henning Jensen, Birgit Habenstein, Karine Madiona, Vincent Olieric, Anja Böckmann, Beat H. Meier & Ronald Melki. Nature Communications. 10 octobre 2013.
DOI : 10.1038/ncomms3575
